在理论上,所有物质都可以被压缩,因为它们都由原子或分子构成,而原子和分子之间有一定的间隙。然而,实际上,不同的物质具有不同的可压缩性,即它们在受到外力作用时发生体积变化的能力。
一般来说,固体的可压缩性相对较小,因为固体的原子或分子之间的排列比较紧密,它们的空隙相对较小。因此,即使在受到外力作用时,固体的体积变化通常也是微小的。但在极端的情况下,例如在高压环境下,固体仍然会发生一定程度的压缩。
液体的可压缩性要比固体稍大一些,因为液体的分子之间的间隙相对较大,它们可以在受到外力作用时发生一定程度的体积变化。
气体是最容易被压缩的物质之一,因为气体分子之间的间隙非常大,它们几乎可以在任何压力下发生较大的体积变化。这也是为什么我们能够通过压缩气体来制造压缩空气或液化气体的原因。
总的来说,虽然所有物质都可以在一定程度上被压缩,但不同类型的物质的可压缩性有很大差异,而且在实际应用中,我们通常根据物质的性质来选择合适的压缩方法。
其实物理可以用更基础直观的方法解释。
物质是有分子组成的,而分子间是靠电磁力维持的,他们之间如果距离合适,就会处于平衡状态,大于这个距离就会体现出引力,小于这个距离就会体现斥力,这一点和弹簧非常相似,本质上说,弹簧的力也是电磁力的宏观体现。
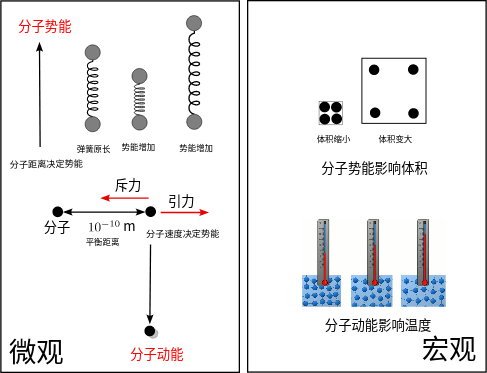
在一般情况下,气体分子之间的引力通常可以忽略不计。这是因为气体分子在大多数情况下相对距离较远,它们之间的相互作用力相对较弱,主要是由于范德华力(Van der Waals forces)引起的。
范德华力是一种短程作用力,通常在分子之间的距离非常近时才会显现出来。在气体状态下,由于分子之间的距离较远,范德华力的效应非常小,因此可以忽略不计。
然而,在某些特殊的情况下,如气体被压缩到非常高的压力下或在低温条件下,分子之间的距离可能会变得更近,这时范德华力可能会对气体的行为产生一些影响。但在一般情况下,我们通常将气体分子之间的相互作用视为非吸引力性的碰撞,以简化问题的处理。
范德华力(Van der Waals forces)是一种分子之间的非共价相互作用力,通常被认为是由于瞬时极化所引起的。这种力得名于荷兰物理学家约翰·范德华,他于1873年首次提出了这一概念。
范德华力主要包括两种类型:
感应力(Induced dipole forces):当一个分子靠近另一个分子时,它的电子云可能会稍微偏离,导致在相邻分子上出现暂时的电偶极矩。这种暂时的电偶极矩会使相邻分子之间产生相互吸引的作用力,这种作用力即为感应力。
色散力(Dispersion forces):所有分子都具有一种瞬时的偶极矩,即使是非极性分子也不例外。由于电子在分子内部的不规则运动,这些瞬时偶极矩会不断地发生变化,从而在空间中产生瞬时的电荷分布不均匀。这种瞬时的电荷分布不均会导致分子之间的相互吸引,形成色散力。
这两种力在不同程度上影响着分子之间的相互作用。范德华力通常在较短的距离范围内起作用,并且与分子的极性和大小有关。虽然范德华力相对于共价键或离子键来说比较弱,但它在许多物理和化学现象中起着重要的作用,例如液体的表面张力、分子之间的吸附作用、气体的压缩性等。
固体的原子或分子排列比较紧密,它们之间的间隙非常小。因此,即使在受到外部压力作用时,固体的原子或分子也没有太多的空间来移动或改变位置,所以固体的体积变化通常非常小,可以说几乎不可压缩。
液体的分子之间的间隙比固体稍大一些,但仍然比较紧密。当液体受到外部压力时,液体分子可以在一定程度上移动,但由于分子之间的相互吸引力比较大,这种移动也会受到限制,因此液体的体积变化也相对较小,即液体也几乎不可压缩。
虽然在极端情况下,如极高的压力或低温下,固体和液体仍然会发生一定程度的压缩,但在一般情况下,我们可以说固体和液体相对于气体来说是不容易被压缩的。
所以水的密度并不会随着深度压强的改变,而像气体一样有巨大的密度变化。
